Theo Bộ Y tế, ở nước ta có nhiều thuốc có tác dụng và chỉ định tương tự thuốc Pembroria đã được cấp giấy đăng ký lưu hành.
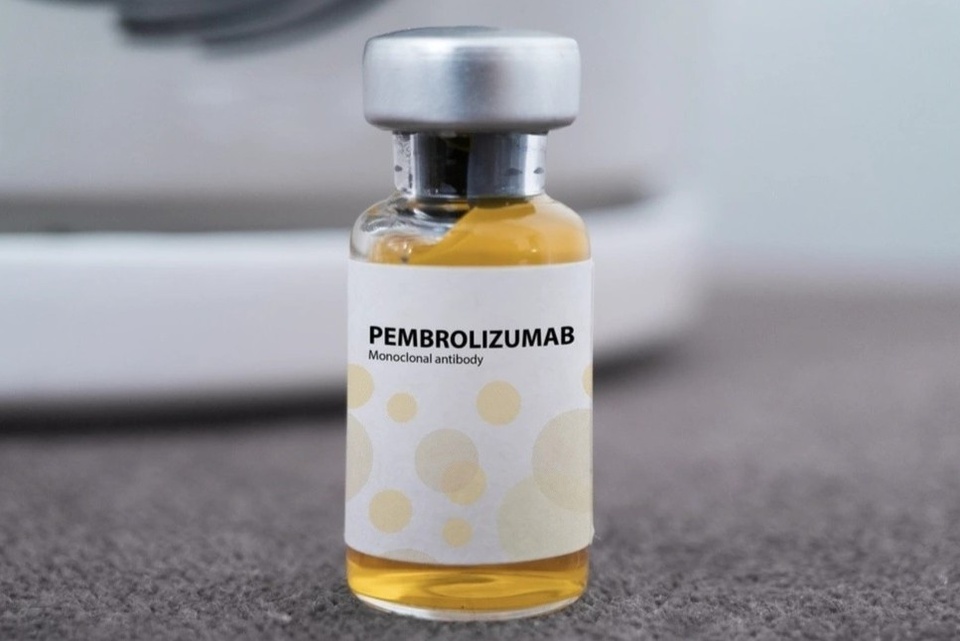 |
| Thuốc Pembroria có hoạt chất chính là Pembrolizumab. Ảnh: Incentra. |
Gần đây, thông tin Việt Nam vừa cấp giấy đăng lý lưu hành cho một loại thuốc điều trị ung thư do Nga sản xuất được lan truyền. Theo xác nhận từ Cục Quản lý Dược, Bộ Y tế, ngày 31/10, ông Vũ Tuấn Cường, Cục trưởng Cục Quản lý Dược, đã ký Quyết định số 628/QĐ-QLD về việc cấp giấy đăng ký lưu hành tại Việt Nam cho 14 vaccine sinh phẩm.
Đáng chú ý trong đó có thuốc thuốc Pembroria (hoạt chất chính là Pembrolizumab, hàm lượng 100 mg/4 ml) do Công ty Limited Liability “PK-137” (Nga) sản xuất điều trị ung thư. Pembrolizumab hiện có hơn 14 chỉ định cho các loại ung thư khác nhau (như ung thư biểu mô phổi, u hắc tố, ung thư đại trực tràng, ung thư cổ tử cung, ung thư biểu mô tế bào thận, ung thư vú…).
Trao đổi với Tri Thức – Znews sáng 12/11, lãnh đạo Cục Quản lý dược, Bộ Y tế, cho biết thông tin từ Phòng đăng ký thuốc cho thấy sinh phẩm tham chiếu đã được cấp giấy đăng ký lưu hành nhiều năm nay. Thuốc Pembroria này của do Nga sản xuất, là sinh phẩm tương tự, mới được cấp giấy đăng ký lưu hành.
Hiện nay, ở nước ta có nhiều thuốc có tác dụng và chỉ định tương tự thuốc Pembroria đã được cấp giấy đăng ký lưu hành.
“Việc cấp số đăng ký lưu hành thêm thuốc Pembroria của Nga tại Việt Nam có ý nghĩa lớn trong bối cảnh nhu cầu lớn về các thuốc tiên tiến điều trị ung thư hiện nay ở nước ta và tăng khả năng tiếp cận các phương pháp điều trị hiện đại cho người bệnh”, vị lãnh đạo nói.
 |
| Bệnh nhân điều trị ung thư tại Bệnh viện K. Ảnh: Việt Linh. |
Theo Cục Quản lý Dược, sau khi được cấp giấy đăng ký lưu hành, công ty phải định kỳ 3 tháng một lần kể từ ngày cấp giấy đăng ký lưu hành thực hiện cập nhật tiến độ triển khai nghiên cứu lâm sàng theo dõi tính sinh miễn dịch pha III. Nộp hồ sơ thay đổi, bổ sung cập nhật dữ liệu theo dõi tính sinh miễn dịch pha III khi thời gian nghiên cứu kết thúc.
Theo Quyết định số 628/QĐ-QLD, việc cấp phép được thực hiện trên cơ sở kết luận của Hội đồng tư vấn cấp giấy đăng kí lưu hành thuốc và nguyên liệu làm thuốc – Bộ Y tế. Cục Quản lý Dược yêu cầu các cơ sở sản xuất và đăng kí thuốc phải tuân thủ đầy đủ các quy định của pháp luật Việt Nam và hướng dẫn của Bộ Y tế về sản xuất, nhập khẩu và lưu hành thuốc.
Các đơn vị này có trách nhiệm cung cấp thuốc theo đúng hồ sơ đã đăng ký, ghi rõ số đăng kí do Bộ Y tế cấp trên nhãn sản phẩm, đồng thời báo cáo kịp thời nếu có bất kỳ thay đổi nào trong quá trình lưu hành tại nước sở tại hoặc tại Việt Nam.
Cục cũng nhấn mạnh các cơ sở đăng ký thuốc phải đảm bảo duy trì tiêu chuẩn “Thực hành tốt sản xuất” (GMP). Trường hợp bị thu hồi giấy phép hoặc không còn đáp ứng yêu cầu GMP tại nước sở tại, cơ sở phải báo cáo cho Cục Quản lý Dược trong vòng 15 ngày kể từ khi có thông báo của cơ quan quản lý nước ngoài.
Bên cạnh đó, các cơ sở sản xuất và đăng ký thuốc cần phối hợp với cơ sở điều trị và cơ sở y tế dự phòng để thực hiện đầy đủ các quy định về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn trên người Việt Nam.
Trao đổi với Thông tin Chính phủ, PGS.TS Phạm Cẩm Phương, Giám đốc Trung tâm Y học hạt nhân và ung bướu, Bệnh viện Bạch Mai, cũng cho hay đây là thuốc điều trị đích trong ung thư, đã có ở Việt Nam nhiều năm nay. Thuốc lần này của Nga sản xuất là sinh phẩm tương tự, mới được cấp phép ở Việt Nam. Điều này sẽ giúp người bệnh có thêm cơ hội được điều trị bệnh với giá phù hợp hơn.
Phương Anh
Nguồn: https://znews.vn/thong-tin-moi-ve-thuoc-ung-thu-cua-nga-vua-duoc-luu-hanh-tai-viet-nam-post1602051.html